Le processus de gestion des risques, qu’est-ce que c’est ?
La gestion des risques est une exigence réglementaire permettant de garantir la sécurité des utilisateurs de dispositifs médicaux. La norme ISO 14791 définit un processus de gestion des risques en quatre étapes :
- L’analyse de risques qui consiste à déterminer les phénomènes dangereux associés au dispositif médical, identifier leurs causes et à estimer leur gravité, probabilité d’apparition et détectabilité.
- L’évaluation du risque permet de définir si le risque est acceptable ou non.
- Lorsque le risque s’avère inacceptable, il est nécessaire de le maîtriser en identifiant des mesures de réduction du risque.
- L’analyse initiale (lors de la conception) est revue en intégrant les informations relatives à la production et la post-production.
Ces étapes doivent être documentées et intégrées au dossier technique en vue de l’obtention du marquage CE. Elles sont applicables à tous les stades du cycle de vie d’un dispositif médical.
Mais quel est le lien entre gestion des risques et aptitude à l’utilisation ?
Le processus d’aptitude à l’utilisation va de pair avec le processus de gestion des risques. En effet, comme décrit dans la norme 62366-1 :2015 : « le processus d’ingénierie de l’aptitude à l’utilisation est destiné à identifier et à minimiser les erreurs d’utilisation et ainsi réduire les risques associés à l’utilisation ». Les erreurs d’usage sont finalement, une des catégories de risque au même titre que les risques bactériologiques, de biocompatibilité, environnementaux ou encore de fabrication et la norme EN 623666-1 :2015 décrit un processus de gestion des risques spécifique à mettre en place.
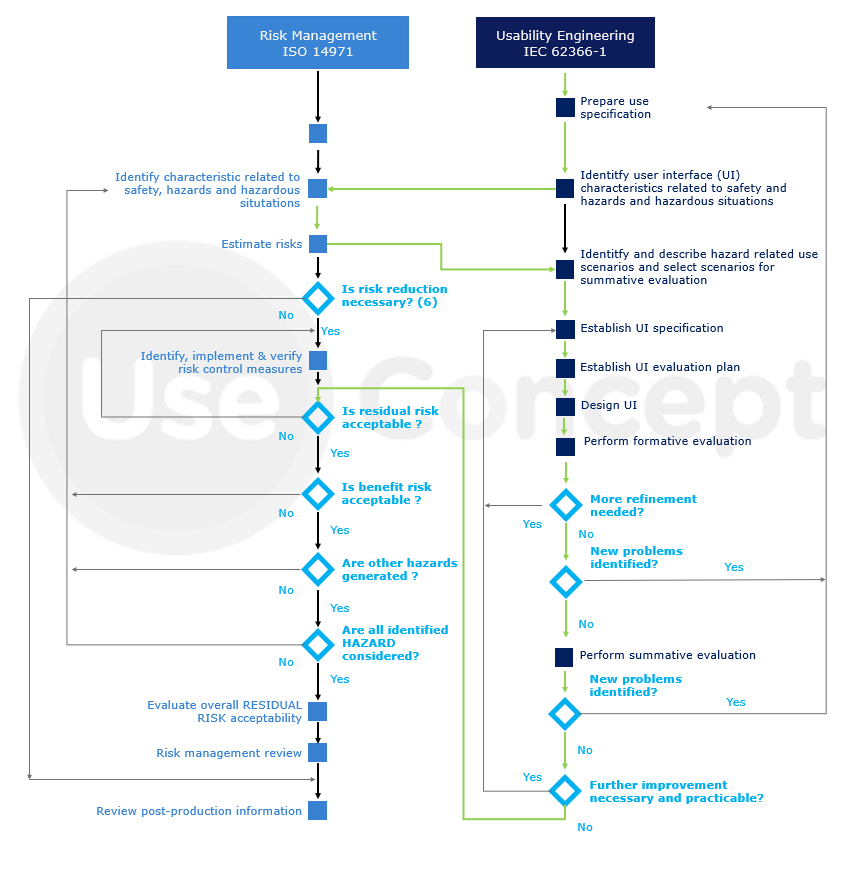
Enfin, la figure suivante illustre d’une part l’articulation et l’intégration du processus d’ingénierie d’aptitude à l’utilisation avec la norme ISO 14971 et d’autre part la continuité du processus avec notamment l’intégration du suivi des usages après commercialisation lors du suivi post-production du dispositif.
Qu’est-ce qu’une erreur liée à l’utilisation ?
Selon la norme EN 62366-1 :2015 « L’erreur d’utilisation est une action de l’utilisateur ou absence d’action de l’utilisateur lors de l’utilisation du dispositif médical, qui aboutit à un résultat différent du résultat prévu par le fabricant ou attendu par l’utilisateur ».
Si vous souhaitez en savoir plus sur l’erreur d’utilisation avec notamment des exemples illustrés, n’hésitez pas à consulter le premier épisode de notre web série dédiée à l’aptitude à l’utilisation.
Comment faire en pratique ?
Il y a deux grandes étapes à réaliser lors de la conception d’un dispositif médical afin de maîtriser les risques liés à l’utilisation. Il faut dans un premier temps analyser les risques puis évaluer les éléments de protection mis en place au niveau de l’interface utilisateur du dispositif. A noter que le processus mis en place afin de réaliser ces deux grandes étapes est itératif et plusieurs phases d’analyse et d’évaluation des risques peuvent avoir lieu lors de la conception du produit puis après sa commercialisation.
Pour effectuer l’analyse des risques d’usage, plusieurs méthodes peuvent être employées. Pas de panique, nous vous les présenterons dans notre prochain article. Concernant l’évaluation et la maîtrise du risque d’usage, la méthode la plus efficace est celle des tests utilisateurs. Mais d’autres méthodes peuvent également être mises en place suivant le niveau de maturité de développement de votre dispositif, on vous en dit plus à travers cet article. Enfin, pour la documentation des informations relatives à la post-production, cela fera l’objet d’un futur article.
En résumé
Vous l’aurez donc compris, le processus d’aptitude à l’utilisation (EN 62366-1 :2015) et le processus global de gestion des risques (ISO 14971) sont étroitement liés. En effet, les risques liés à l’utilisation sont au cœur du processus d’aptitude à l’utilisation et doivent être documentés, évalués et maîtrises lors des différentes étapes du cycle de vie du dispositif !
Si vous voulez en savoir plus sur le processus d’aptitude à l’utilisation, n’hésitez pas à entrer en contact avec nous, nos ergonomes se feront un plaisir de répondre à vos questions !